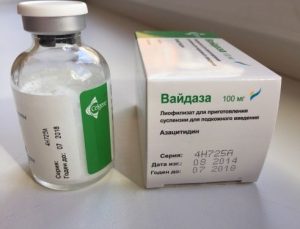
Торговое название препарата: Вайдаза (Vidaza)
Международное непатентованное название: Азацитидин
Форма выпуска
Лиофилизат для приготовления суспензии для п/к введения.
Клинико-фармакологическая группа
Противоопухолевый препарат. Антиметаболит.
Состав:
Лиофилизат для приготовления суспензии для п/к введения — 1 фл. азацитидин
Фармакологическое действие
Противоопухолевое действие азацитидина обусловлено разнообразными механизмами, включая цитотоксичность в отношении патологически измененных гематопоэтических клеток костного мозга и гипометилирование ДНК. Механизмы, участвующие в реализации цитотоксического действия азацитидина, включают ингибирование синтеза ДНК, РНК и белка, инкорпорацию препарата в ДНК и РНК, а также активацию путей повреждения ДНК. Непролиферирующие клетки практически не чувствительны к азацитидину. Инкорпорация азацитидина в ДНК приводит к инактивации метилтрансферазы ДНК, в результате чего происходит гипометилирование ДНК. Гипометилирование ДНК в аберрантно метилированных генах, присутствующее и в регуляторном цикле нормальных клеток, их дифференциации и клеточной смерти, может вызывать ре-экспрессию гена и восстановление свойств подавления опухолевого роста у самих раковых клеток. Клиническая значимость механизма гипометилирования ДНК в сравнении с цитотоксическим и другими эффектами азацитидина еще не установлена.
Клиническая эффективность и безопасность Вайдазы была подтверждена результатами многоцентрового рандомизированного исследования III фазы. У больных с миелодиспластическим синдромом, хроническим миеломоноцитарным лейкозом и острым миелолейкозом терапия Вайдазой превосходила современную традиционную терапию по всем критериям эффективности, включая продолжительность жизни и общую частоту ответа на лечение.
Фармакокинетика
Абсорбция. После подкожного введения азацитидин быстро абсорбируется; достигая Cmax 750±403 нг/мл через 0.5 ч после введения. Абсолютная биодоступность азацитидина при подкожном введении составляет 89% по отношению к данному показателю при в/в введении на основании результатов определения AUC.
Метаболизм. Результаты исследования iп vitro показали, что в метаболизме азацитидина не участвуют изоферменты системы цитохрома Р450, UDP-глюкуронилтрансфераза, сульфотрансфераза и глютатионтрансфераза. Азацитидин метаболизируется путем спонтанного гидролиза и дезаминирования, которое индуцируется цитидиндезаминазой.
Выведение. Азацитидин быстро выводится из организма, его T1/2 после подкожного введения составляет 41±8 мин. Большая часть азацитидина (50-85%) и/или его метаболитов выводится почками. Через кишечник выводится менее 1% препарата. Данных о поступлении азацитидина в грудное молоко нет.
Влияние нарушения функции печени или почек, а также возраста, пола или расы на фармакокинетические параметры азацитидина не изучалось.
Показания к применению:
Вайдаза применяется для лечения взрослых больных, которым не может быть выполнена трансплантация гемопоэтических стволовых клеток, имеющих:
- миелодиспластический синдром (МДС) с высокой или промежуточной-2 степенью риска в соответствии со шкалой IPSS(Международная прогностическая система баллов);
- острый миелоидный лейкоз;
- хронический миеломоноцитарный лейкоз без признаков МДС.
Внимание! Не следует назначать себе лекарство, пользуясь информацией этого раздела. Эффект, оказываемый препаратами, очень индивидуален, и назначать их должен только доктор.
Противопоказания:
- повышенная чувствительность к азацитидину или другим компонентам препарата;
- распространенные метастазы в печени;
- беременность и период кормления грудью;
- детский возраст (отсутствие данных по эффективности и безопасности).
С осторожностью. У больных сердечно-сосудистыми заболеваниями, заболеваниями легких, с нарушениями функции почек и печени, включая обширные метастатические поражения печени.
Дозировка
Препарат Вайдаза вводится подкожно в область предплечья, бедра или живота. Места инъекции должны чередоваться. Место для очередной инъекции должно находиться более чем на 2.5 см от предыдущего. Вайдаза не должна вводиться в поврежденные, гиперемированные, уплотненные или болезненные участки кожи (в том числе в участки кожи с кровоизлияниями).
Перед введением Вайдазы рекомендуется назначить противорвотные препараты. Рекомендуемая начальная доза препарата Вайдаза при проведении первого цикла терапии для всех больных, независимо от значений исходных гематологических показателей, составляет 75 мг/м2 поверхности тела, которая вводится ежедневно в течение 7 дней с последующим перерывом в 21 день (28-дневный терапевтический цикл).
Должно быть проведено не менее 6 терапевтических циклов. Лечение продолжают до тех пор, пока сохраняется его эффективность или до появления симптомов прогрессирования заболевания.
В ходе наблюдения за больными оценивают ответ со стороны показателей крови и возможные проявления токсичности, в частности со стороны крови и почек, которые могут требовать отсрочки следующего курса лечения или модификации дозы препарата. Ниже представлены возможности модификации дозы препарата Вайдаза при развитии различных видов токсичности
Модификация дозы при выявлении симптомов гематологической токсичности
Больные, с исходными (до начала терапии Вайдазой) показателями количества лейкоцитов >3.0 х 109/л, абсолютного количества нейтрофилов >1.5 х 109/л, количества тромбоцитов >75.0 х 109/л.
Если на фоне лечения препаратом Вайдаза у этих пациентов появляются симптомы гематологической токсичности, следующий цикл лечения препаратом откладывается до восстановления количества тромбоцитов и абсолютного количества нейтрофилов до исходных значений. Если продолжительность восстановительного периода не превышает 14 дней, модификации дозы препарата не требуется. Если количество клеток крови не увеличилось до необходимого уровня в течении 14 дней, доза препарата должна быть снижена согласно рекомендациям изложенным ниже. При использовании модифицированной дозы, продолжительность цикла терапии должна восстановиться до 28 дней.
| Количество клеток крови | % от начальной дозы для следующего цикла, если восстановление* количества клеток крови потребовало больше 14 дней | |
| Абсолютное количество нейтрофилов | Количество тромбоцитов | |
| ≤ 1.0 х 109/л | ≤ 50.0 х 109/л | 50% |
| > 1.0 х 109/л | > 50.0 х 109/л | 100% |
* Восстановление = количество (к-во) ≥ минимальное к-во + (0.5 х [Исходное к-во -минимальное к-во])
Больные с исходными (до начала терапии Вайдазой) показателями количества лейкоцитов <3.0 х 109/л, абсолютного количества нейтрофилов <1.5 х 109/л, количества тромбоцитов <75.0 х 109/л.
Если перед очередным курсом лечения препаратом Вайдаза наблюдается снижение количества лейкоцитов или абсолютного количества нейтрофилов или тромбоцитов не более 50% от их исходных значений, или более 50%, но при наличии признаков улучшения дифференциации любого клеточного ростка, схема введения препарата Вайдаза и его доза не должны меняться.
Больным, у которых количество клеток крови не превысило 50% порога от исходного уровня при отсутствии признаков улучшения дифференцировки клеточных ростков, очередной курс лечения препаратом Вайдаза должен быть отсрочен до восстановления абсолютного количества нейтрофилов и тромбоцитов. Если восстановительный процесс занял не более 14 дней, корректировка дозы препарата Вайдаза не требуется. Если количество клеток крови не достигло желаемого уровня в течение 14 дней, необходимо определение клеточного насыщения костного мозга. При показателе клеточного насыщения > 50% не требуется изменения дозы препарата. Если клеточная насыщенность костного мозга ≤ 50%, введение препарата Вайдаза должно быть отложено, а доза уменьшена согласно приведенным в таблице рекомендациям:
| Клеточное насыщение костного мозга | % от начальной дозы для следующего цикла, если восстановление* количества клеток крови потребовало больше 14 дней | |
| Восстановление* ≤ 21 день | Восстановление* >21 день | |
| 15-50% | 100% | 50% |
| <15% | 100% | 33% |
* Восстановление = количество (к-во) ≥ минимальное к-во + (0.5 х [Исходное к-во — минимальное к-во])
После модификации дозы, продолжительность цикла должна быть восстановлена до 28 дней.
Способ применения и дозы:
Вайдаза вводится подкожно в область плеча, бедра или живота. Места инъекции должны чередоваться. Место для очередной инъекции должно находиться более чем на 2,5 см от предыдущего. Вайдаза не должна вводиться в поврежденные, гиперемированные, уплотненные или болезненные участки кожи (в том числе в участки кожи с кровоизлияниями).
Перед введением препарата рекомендуется назначить противорвотные препараты.
Рекомендуемая начальная доза Вайдазы при проведении первого цикла терапии для всех пациентов, независимо от значений исходных гематологических показателей, составляет 75 мг/м2 поверхности тела. Препарат вводится ежедневно в течение 7 дней с последующим перерывом в 21 день (28- дневный терапевтический цикл).
Должно быть проведено не менее 6 терапевтических циклов. Лечение продолжают до тех пор, пока сохраняется его эффективность или до появления симптомов прогрессирования заболевания.
В ходе наблюдения за пациентами оценивают ответ со стороны показателей крови и возможные проявления токсичности, в частности, со стороны крови и почек, которые могут потребовать отсрочки следующего курса лечения или модификации дозы препарата.
Особенности применения у отдельных групп пациентов
Применение у пациентов с нарушениями функций почек
Не требуется изменять стартовую дозу Вайдазы у пациентов с нарушениями функции почек. При необъяснимом снижении концентрации бикарбонатов в сыворотке менее 20 ммоль/л доза препарата для следующего цикла терапии должна быть уменьшена на 50%. При необъяснимом повышении концентрации креатинина сыворотки крови или концентрации азота мочевины в крови в 2 или более раза от исходных значений или выше верхней границы нормы очередной цикл терапии должен быть отложен до восстановления этих параметров до нормальных или исходных значений, а доза препарата в следующем цикле должна быть уменьшена на 50%.
Применение у пациентов с нарушениями функций печени
Специальных исследований у пациентов с нарушениями функций печени не проводилось. Состояние пациентов с тяжелой печеночной недостаточностью следует тщательно мониторировать для своевременного выявления нежелательных явлений. Данной категории пациентов не требуется изменять начальную дозу Вайдазы. Последующее изменение дозы будет зависеть от результатов исследования крови.
Пожилые пациенты
Пожилым пациентам не требуется специального режима дозирования. Поскольку у пожилых пациентов вероятность нарушения функции почек выше, во время лечения рекомендуется мониторировать функцию почек.
Дети и подростки
Вайдазу не рекомендуется назначать детям младше 18 лет ввиду недостаточного клинического опыта.
Рекомендации по приготовлению раствора и проведению инъекции
Содержимое флакона с препаратом растворяют в 4 мл воды для инъекций до концентрации 25 мг/1 мл. После добавления воды во флакон для инъекций его необходимо энергично потрясти до получения однородной суспензии белого цвета. Если необходимая доза превышает 100 мг, используют 2 флакона с препаратом. Непосредственно перед введением необходимо повторно перевести содержимое шприца в состояние суспензии. Для этого энергично покатайте шприц между ладонями до получения однородной суспензии белого цвета. Температура суспензии во время инъекции должна составлять 20-25°С. Не используйте препарат, если он содержит крупные частицы. Для проведения подкожной инъекции рекомендуется использовать иглу 25 калибра, при этом игла вводится под кожу плеча, бедра или живота под углом 45-90°. В одну область вводится не более 4 мл растворенного препарата. Дозы более 4 мл следует вводить в 2 разные области.
Суспензию Вайдазы следует готовить непосредственно перед использованием. Готовую суспензию хранить при температуре не более 25°С в течение 45 минут или при температуре от 2°С до 8°С не более 8 часов. Перед введением дайте шприцу достичь температуры 20-25°С (но не более, чем в течение 30 минут). Если данные временные ограничения превышены, приготовленная суспензия должна быть уничтожена соответствующим образом, взамен её должна быть приготовлена новая суспензия.
Побочные действия:
Наиболее частыми нежелательными явлениями при лечении азацитидином являлись гематологические реакции (71,4%), включая тромбоцитопению, нейтропению и лейкопению (обычно 3-4 степени тяжести); желудочно- кишечные осложнения (60,6%) включая тошноту и рвоту (обычно 1-2 степени тяжести) или реакции в месте введения (77.1%; степень тяжести 1-2).
К наиболее частым (>2%) серьезным нежелательным реакциям также относятся фебрильная нейтропения (8,0%) и анемия (2.3%). Среди других серьезных нежелательных реакций отмечались сепсис на фоне нейтропении, пневмония, тромбоцитопения и кровотечения (например, внутричерепные).
Частота побочных реакций, приведенных ниже, определялась соответственно следующей градации: очень часто: (>1/10); часто (>1/100,<1/10); нечасто (>1/1000, <1/100), редко (>1/10000, <1/1000), очень редко (< 1/10000); частота не установлена (оценить по имеющимся данным невозможно).
Со стороны системы кроветворения: очень часто — нейтропения, фебрильная нейтропения, лейкопения, тромбоцитопения, анемия; часто — панцитопения.
Со стороны органов пищеварения: очень часто — диарея, запор, тошнота, рвота, боль в животе, анорексия; часто — желудочно-кишечное кровотечение, геморроидальное кровотечение, стоматит, кровоточивость десен, диспепсия.
Со стороны печени и желчевыводящих путей: нечасто — печеночная недостаточность; прогрессирующая печеночная кома.
Со стороны нервной системы: очень часто — головокружение, головная боль; часто — внутричерепное кровотечение, сонливость.
Со стороны сердечно-сосудистой системы: Часто — повышение или снижение артериального давления, гематомы.
Со стороны органов дыхания: Очень часто — одышка; часто — одышка при физической нагрузке, боль в гортани и глотке; редко — интерстициальные заболевания легких.
Со стороны мочевыделительной системы: часто — гематурия, почечная недостаточность; повышение концентрации креатинина; нечасто — почечный канальцевый ацидоз.
Со стороны кожи и подкожно-жировой клетчатки: очень часто — петехии, зуд, сыпь, экхимозы; часто — пурпура, алопеция, эритема, пятнистая сыпь; нечасто — острый фебрильный нейтрофильный дерматоз.
Со стороны костно-мышечной системы: очень часто — артралгия; часто — боли в мышцах и костях, миалгия.
Со стороны органа зрения: часто — внутриглазные кровотечения, кровоизлияния в конъюнктиву.
Инфекции: очень часто — пневмония, назофарингит; часто — сепсис на фоне нейтропении, инфекции верхних дыхательных путей и мочевыводящих путей, воспаление подкожной клетчатки, синусит, фарингит, ринит, простой герпес; частота не установлена — некротизирующий фасциит.
Со стороны иммунной системы: нечасто — реакции гиперчувствительности.
Метаболические расстройства: очень часто — анорексия; часто — гипокалиемия; редко — синдром лизиса опухоли.
Нарушения психики: часто — спутанность сознания, тревожность, бессонница.
Местные реакции: очень часто — боль, покраснение и неспецифические реакции в месте введения; часто — кровоточивость, кровоизлияние, гематома, уплотнение, воспаление, сыпь, зуд, изменение цвета кожных покровов, образование узелков и болезненность в месте введения; Редко — некроз тканей в месте введения.
Прочие: очень часто — слабость, лихорадка, боли в области грудной клетки; часто — уменьшение массы тела, недомогание.
Сообщалось об одном случае передозировки азацитидина в ходе клинического исследования. У больного отмечалась диарея, тошнота и рвота после однократного внутривенного введения препарата в дозе 290 мг/м2, которая превышает рекомендованную начальную дозу почти в 4 раза. Рекомендуется мониторировать уровень соответствующих клеток крови и назначать, при необходимости, поддерживающее лечение. Не существует специфического антидота при передозировке азацитидина.
Взаимодействие:
Не проводилось целенаправленных клинических исследований взаимодействия азацитидина с другими лекарственными препаратами. Данные исследований in vitro свидетельствуют о том, что участие изоферментов системы цитохрома Р450, UDP-глюкуронилтрансферазы, сульфотрансферазы и глютатионтрансферазы в метаболизме азацитидина маловероятно. В связи с этим, взаимодействие in vivo с данными ферментами, участвующими в метаболизме, не представляется клинически значимым.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Условия и сроки хранения
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С. Срок годности — 4 года.
Производитель Селджен, Великобритания, Фармстандарт-Уфавита, Россия